发布日期:2024-11-12 05:24 点击次数:146

(原标题:华东医药首个国产乌司奴单抗打针液获批上市,自免领域龙头再下一城!)
11月5日,华东医药(SZ.000963)公告称,其全资子公司杭州中好意思华东制药有限公司(以下简称“中好意思华东”)收到国度药品监督处分局(NMPA)核准签发的《药品注册文凭》,由中好意思华东呈文的乌司奴单抗打针液(赛乐信®)(研发代码:HDM3001/QX001S)的上市许可肯求取得批准,用于救援成年中重度斑块状银屑病,成为国内首个获批的乌司奴单抗生物肖似药。
首个国产乌司奴单抗霸占先机,改造研发不休冲破
公告走漏,赛乐信®用于斑块状银屑病的救援,是原研居品Stelara®(喜达诺®,乌司奴单抗打针液)的生物肖似药,作用机理为阻断IL-12和IL-23共有的p40亚基与靶细胞名义的IL-12Rβ1受体卵白的迷惑,从而遏制IL-12和IL-23介导的信号传导和细胞因子级联响应。IL-12和IL-23是两种自然存在的细胞因子,在免疫介导的炎症性疾病中施展注重要作用。
Stelara®由好意思国强生公司研发,于2017年在中国获批上市,商品名为喜达诺®,现在在国内获批的顺应症有成东谈主斑块状银屑病、儿童斑块状银屑病及克罗恩病。
流行病学拜谒着力走漏,中国现存最初670万银屑病患者。斑块状银屑病约占统统银屑病患者的80%~90%,是银屑病中最常见的类型。现在中国银屑病救援已步入生物制剂期间,相较于传总揽疗,生物制剂频繁具有更优的疗效和邃密的安全性。其中白细胞介素类遏制剂的疗效及安全性相对TNF-α遏制剂更有上风,如IL?12/23遏制剂、IL?17A遏制剂、IL-23p19遏制剂等。乌司奴单抗打针液给药款式为:初度45 mg皮下打针,4周后及之后每12周予以一次换取剂量,保管期一年仅需4针,是现在银屑病救援领域给药频次最低的生物制剂之一,使用便利性高,且安全性、耐受性邃密、疗效捏久。公共范围内上市16年来,乌司奴单抗打针液已在各项针对银屑病的临床历练及信得过全国盘登科集中了丰富的愚弄警告。
赛乐信®已完成的“一项在成年中重度斑块状银屑病患者中相比QX001S打针液和乌司奴单抗打针液(喜达诺®)的有用性和安全性的多中心、立时、双盲、平行对照Ⅲ期临床盘考”是国内首个针对乌司奴单抗生物肖似药的大边界临床盘考,为中国东谈主群使用乌司奴单抗打针液进一步提供了丰富的临床把柄及警告。
值得一提的是,中国银屑病药物市集边界正在快速增长。据弗若斯特沙利文通告,中国银屑病药物市集比年来呈现出强盛的增长势头,市集边界从2018年的6.04亿好意思元赶快增长至2022年的14.36亿好意思元,年复合增长率达到24.2%。中国银屑病药物市集到2025年有望达到32.55亿好意思元,瞻望在2030年将达到94.6亿好意思元。同期,生物肖似药在银屑病药物市集的份额也在稳步进步,瞻望到2030年将占到57%。这关于首个获批上市的国产乌司奴单抗生物肖似药赛乐信®而言将是广博的契机。
其次,原研药Stelara®在中国市集的专利到期,也给了赛乐信®填补市集的契机。乌司奴单抗是自免领域第二大强势品种,终年稳居自免TOP榜单第二。乌司奴单抗氨基酸序列在中国的专利已于2021年8月到期,而好意思国及欧洲的专利如故于2023年9月及2024年1月到期。2023年,乌司奴单抗市集进展亦然相配强盛,据强生公司年报走漏,根据强生公司2023年报,2023年Stelara®在公共的销售额为108.58亿好意思元(约767.29亿元东谈主民币)。在国内,根据米内网公立病院末端(城市公立病院、县级公立病院)、公立下层医疗末端(城市社区、州里卫生院)及零卖药店末端(城市实体药店)数据库,2023年喜达诺®的销售为13.22亿元东谈主民币。
这次赛乐信®获批上市,成为国内首个乌司奴单抗打针液生物肖似药,亦有望改变国内银屑病救援模式,进一步提高国内用药的可及性,补位更多临床救援中的需求空白。
各异化全面布局,打造自免领域龙头上风
这次获批的赛乐信®是华东医药和荃信生物聚会研发。荃信生物是国内自己免疫及过敏性疾病领域生物药物管线布局最为全面且合座成立过程最最初的公司之一。2020年8月17日,华东医药出资 37,000 万元取得荃信生物20.56%股权,成为其第二大股东。
华东医药如故变成银屑病救援“黄金组合”,布局了生物制剂乌司奴单抗打针液、口服小分子药物环孢素软胶囊、ZORYVE®乳膏和泡沫剂以及复方外用制剂Wynzora®乳膏,有望为儿童及成东谈主银屑病患者带来更多用药继承,驱散全周期全东谈主群遮蔽。
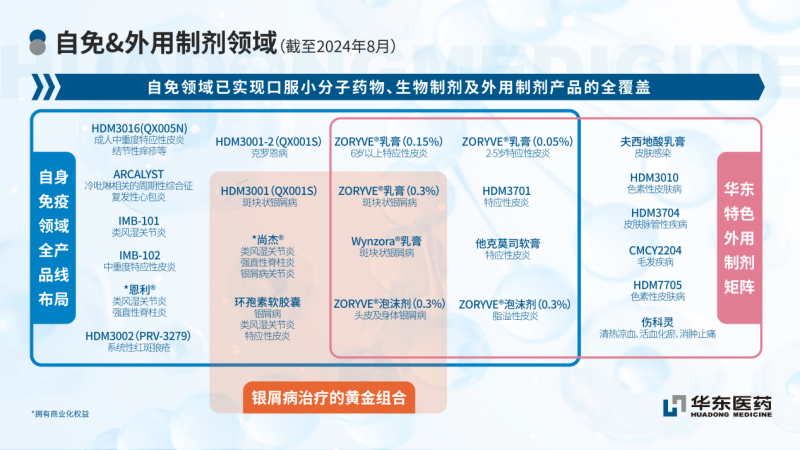
自己免疫领域是华东医药要点发展的三大中枢救援领域之一。比年来,公司不休围绕自己免疫领域进行深化布局,引进公共最初的改造本领与居品,同期捏续进步自己改造研发才能。公司现存居品及在研居品顺应症涵盖移植免疫、类风湿要津炎、系统性红斑狼疮、银屑病、特应性皮炎、脂溢性皮炎、复发性心包炎、冷吡啉干系的周期性轮廓征等顺应症,遮蔽皮肤、风湿、心血管、呼吸、移植等疾病种类,是国内自己免疫性疾病领域种类遮蔽最全的医药公司之一。现在,公司在自免疾病领域已领有生物药和小分子改造居品10余款。同期,公司改造药研发中心自主成立的多个全新靶点和生物学机制的免疫疾病早期样貌,均在顺利股东中。
就在2024年7月,华东医药引进了荃信生物的QX005N居品。据公告走漏,QX005N是由荃信生物自主研发的一款以东谈主IL-4受体α亚基(IL-4Rα)为靶点的改造型东谈主源化单克隆抗体,对2型炎症过敏性疾病施展救援作用。据悉,QX005N打针液是中国IL-4Rα靶向候选药物中顺应症取得IND许可最多的居品,已在国内取得用于救援成东谈主中重度特应性皮炎、12-17岁青少年特应性皮炎、结节性痒疹、慢性鼻窦炎伴有鼻息肉、慢性自愿性荨麻疹、哮喘及慢性防止性肺疾病的7项IND许可,现在,QX005N打针液针对成东谈主中重度特应性皮炎及结节性痒疹的两项国内III期临床历练均在入组中。
本年8月,华东医药又取得韩国IMB公司两款自己免疫领域的公共改造居品IMB-101及IMB-102。IMB-101是靶向OX40L和TNFα的双特异性抗体,正在好意思国进行临床Ⅰ期盘考,拟用于救援类风湿要津炎。IMB-102是靶向OX40L的单抗,现在处于临床前盘考,潜在顺应症为中重度特应性皮炎偏激他自己免疫性疾病。
值得一提的是,公司引入的公共创始自免新药打针用利纳西普(ARCALYST)也处在上市冲刺重要阶段,是FDA批准的唯独一款适用于12岁及以上东谈主群的救援复发性心包炎药物,在国内被列入临床急需境外新药目次。打针用利纳西普救援冷吡啉干系的周期性轮廓征(CAPS)以及救援复发性心包炎的上市肯求分辨于2023年11月以及2024年3月取得NMPA受理,有望于年内不时获批上市。CAPS和复发性心包炎齐是目生病,在国内面对广博的未繁荣临床救援需求。Kiniksa最新的三季报数据走漏,Arcalyst 2024年第三季度净居品收入为1.122亿好意思元,同比增长73%,Kiniksa瞻望2024年Arcalyst 总销售净收入为4.1-4.2亿好意思元,较昔时预测的4.05-4.15亿好意思元有所增长。
这次赛乐信®获批上市是华东医药在自免及银屑病赛谈又一进军的里程碑,其动作首个获批的乌司奴单抗生物肖似药,有意于华东医药快速抢滩国内自己免疫生物制剂用药市集,进一步在数十亿市集的风浪突变中安祥壮健的竞争力,助力华东医药加快问鼎自免领域。
本文开始:财经报谈网足球外盘网站app官网
Powered by 足球外盘网站有哪些(中国)官方网站-登录入口 @2013-2022 RSS地图 HTML地图
Copyright Powered by365建站 © 2013-2024